¿De qué color son los gases?
De la estructura electrónica del átomo a la luz de las lámparas de descarga
Entrada basada en el siguiente hilo de Twitter:
Se suele decir que los gases (la mayoría) son incoloros. Entonces, ¿por qué hay lámparas de vapor de distintos colores, y por qué se estudian las líneas espectrales del hidrógeno, el helio, etc.? En el hilo de hoy, hablamos de estructura electrónica, luz y color.🧵 pic.twitter.com/LJYHEQQ5Pt
— Manuel Alonso (@ManoloAlonso1) October 3, 2022
Se suele decir que los gases (la mayoría) son incoloros. Entonces, ¿por qué hay lámparas de vapor de distintos colores, y por qué se estudian las líneas espectrales del hidrógeno, el helio, etc.? En esta entrada hablamos de estructura electrónica, luz y color.
Empecemos con los átomos más sencillos, el hidrógeno (H) y el helio (He). En un átomo, los electrones (➖) se mantienen ligados al núcleo (➕) por interacción electromagnética (EM) en niveles de energía bien definida; para el H y el He, tenemos 1 o 2 e– en el mismo nivel (n = 1).
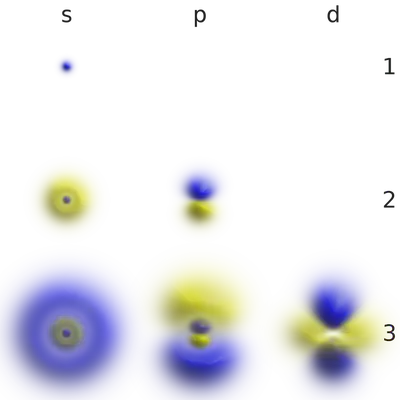
En la imagen anterior, basada en el modelo de Bohr, los e– orbitan como planetas en torno a su estrella, pero por interacción EM. Por las limitaciones de este modelo, en vez de órbitas, es más realista imaginar a los electrones alrededor del núcleo como orbitales de probabilidad.
. Una mayor intensidad de color indica las regiones en las que es más probable que existan electrones. Los nodos (*nodes*) indican las regiones en las que la probabilidad de encontrar un electrón es nula. Adaptada de https://www.khanacademy.org/science/physics/quantum-physics/quantum-numbers-and-orbitals/a/the-quantum-mechanical-model-of-the-atom.](/blog/2022/10/19/de-que-color-son-los-gases/distribuciones-probabilidad-orbitales_hu_fa174e20d89ea3d0.webp)
En ambos modelos, el litio neutro tiene tres electrones; dos de ellos a cierta energía y un tercero a mayor energía (es decir, a menor energía de enlace). En el modelo de Bohr, se visualiza como una órbita a mayor distancia del núcleo. El modelo de Schrödinger es más completo pues, entre otras, tiene en cuenta la indeterminación en la posición-momento del electrón, dando lugar a resultados experimentales más exactos.
En el átomo, los electrones se encuentran en niveles definidos por su energía, la misma para todo átomo aislado de un mismo elemento, como el hidrógeno o el litio. Por ejemplo, estos son los niveles energéticos del hidrógeno (1 eV es la energía de un e– acelerado por una diferencia de potencial de 1 V).
En el estado fundamental, el átomo de hidrógeno tiene un electrón, que se encuentra en el nivel de menor energía (n = 1). Entonces, ¿emitirá un color (fotón con energía en el rango visible) o más? Si lo hace, ¿por qué se dice que, como la mayoría de los gases, el H es incoloro?
Para que el átomo emita luz, se debe primero excitar a su(s) electrón(es) a niveles de energía superiores. Una forma de hacerlo es absorbiendo radiación, pero la energía requerida para el hidrógeno atómico es mayor que la luz visible e incluso que la radiación ultravioleta cercana.
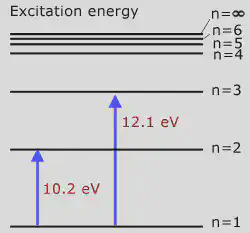
Físicamente, ¿qué quiere decir “excitar al electrón a niveles de energía superiores”? Según el modelo de Bohr, sería llevarlo a órbitas más lejanas del núcleo; visto desde el modelo cuántico, cambia su distribución de probabilidad en torno al núcleo.
Aquí podéis ver una animación que muestra los orbitales atómicos:
Los orbitales atómicos son especialmente bonitos. Os enseñamos algunos de ellos: pic.twitter.com/kAxtr23d0x
— Crespo (@QuantumFracture) September 19, 2022
, y un vídeo donde se explican con más detalle, ambos de @QuantumFracture:
Aquí vamos a centrarnos en la relación entre esos estados del hidrógeno y la luz que emite. Cuando el e– retorna de esos niveles excitados a niveles inferiores, la diferencia de energía es igual a la de la radiación que emite. En el H, es visible si cae al nivel n = 2. Las transiciones electrónicas son probabilísticas; excitando suficientes átomos de H, tendremos las cuatro emisiones:
. En este ejemplo, el electrón había pasado al nivel n = 6 y la luz emitida sería la de 410 nm; las demás ocurren cuando el electrón pasa por los niveles correspondientes. Las emisiones entre niveles superiores y el nivel n = 1 (no mostradas aquí) dan lugar a radiación ultravioleta. Para emitir alguna de esas longitudes de onda, el átomo debe haber previamente absorbido [una energía por encima de 12 eV](#figure-energia-excitaciones).](/blog/2022/10/19/de-que-color-son-los-gases/desexcitaciones-electronicas-H_hu_183cc073746a26a1.webp)
Esas longitudes de onda (colores) emitidas por el hidrógeno no solo se pueden calcular, sino también medir en un laboratorio. Para darle suficiente energía para activar esas transiciones electrónicas, se somete al gas a una corriente eléctrica.
 (abajo) mediante un [espectroscopio](https://es.wikipedia.org/wiki/Espectrómetro) que se puede fabricar en un laboratorio casero. Para más información, pincha [aquí](http://rsefalicante.umh.es/TemasColor/cuantica_profesor.pdf). Vemos que modelo teórico cuadra maravillosamente con el experimento.](/blog/2022/10/19/de-que-color-son-los-gases/tubo-descarga-H_hu_60926f9f6a7fa48c.webp)
El experimento anterior es análogo al prisma de Newton, donde se vio que la luz blanca está compuesta de muchas longitudes de onda (colores del arcoíris). Pero aquí solo hay cuatro: una roja (más intensa), dos azules y una violeta, que combinadas dan lugar al color rosa del tubo de hidrógeno.
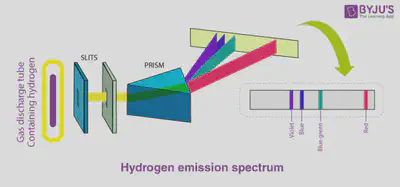
Quedaría por añadir que la probabilidad de transición de los niveles energéticos del hidrógeno que dan lugar a estas cuatro líneas espectrales es máxima para la roja y mínima para la violeta, de ahí que en el espectroscopio casero no podamos ver la violeta y que la roja domine en el tubo de hidrógeno, dando lugar a una luz de color intenso rosáceo para nuestros ojos.
No solo tenemos tubos de descarga de hidrógeno; también de muchos otros gases, como el helio o el neón. En general, cuantos más electrones tenga el átomo, al haber más niveles de energía accesibles, habrá más líneas de emisión (en el rango visible, más colores).

Esta es la base de las lámparas de descarga, como las naranjas que aún hay en muchas ciudades, donde la especie atómica usada para lograr esa emisión es el sodio.
Si quieres profundizar en este tema te recomiendo este 🧵 hilo de Twitter de @Yosoycorra:
Hace unos años esta foto se hizo viral.
— Jorge Corrales (@Yosoycorra) February 18, 2022
El muro de Berlín, destruido hace años, vuelve a hacerse visible gracias a las luces de la ciudad.
Pero no solo eso.
La historia del siglo XX se puede rastrear siguiendo las luces de la ciudad.
¿Me acompañáis? #berlinespobreperosexy pic.twitter.com/JiO98xpJYr
Dos aclaraciones importantes:
- El hidrógeno, como la mayoría de los gases, es en circunstancias habituales incoloro. Además, suele estar formado por moléculas de H2. Al aplicar la corriente, parte de ellas se disocia y los colores se deben a lo que hemos visto en la entrada para el hidrógeno atómico.

- La corriente ioniza un porcentaje de los átomos de hidrógeno; esos átomos se quedan sin su electrón ligado. Por ello, en los tubos de descarga que hemos visto se forma un plasma; si queréis leer más sobre el plasma, escribí una entrada sobre ello.
Con esto termina esta entrada, donde hemos visto modelos físicos y experimentos que nos han arrojado luz en muchos sentidos; desde la comprensión de la estructura de la materia hasta el desarrollo de la iluminación en nuestras poblaciones.

Participa activamente en la web comentando, dando tu opinión, realizando peticiones, sugerencias...

Discord