Sonrisa de fluoruro
La invención y desarrollo de los electrodos selectivos de iones
Entrada basada en los siguientes hilos de Twitter:
23/365
— Ricardo M. A. Estrada Ramírez (@ricestrada) January 24, 2021
En la década de 1960, en EU se empezó a añadir fluoruro (F-) a los suministros municipales de agua para evitar la formación de caries. Esto implicó que se debía cuantificar la concentración de F-. El método analítico que existía para determinar F- era complicado y costoso
33/365
— Ricardo M. A. Estrada Ramírez (@ricestrada) February 3, 2021
En la Tierra, el material más duro que se puede extraer de una mina es el diamante. En el cuerpo humano, el material más duro que podemos encontrar es el esmalte dental cuyo componente principal es la hidroxiapatita. pic.twitter.com/lw5Kv8a5Zv
La evolución de la ciencia y la tecnología no es lineal, ni secuencial. La invención y desarrollo de los electrodos selectivos de iones es un ejemplo de ello ya que, a pesar de existir la tecnología para usarlos y literatura especializada con propuestas para elaborarlos, tuvo que pasar un tiempo para concretar su construcción.
La creación de una necesidad analítica
En la década de 1960, en Estados Unidos, se empezó a añadir fluoruro (en concentraciones de 1 ppm = 1 mg/L, aproximadamente) a los suministros municipales de agua para evitar la formación de caries. Esto generó la necesidad de medir la concentración de fluoruro de una manera sencilla y selectiva.
En ese momento, el método analítico que existía para determinar fluoruro implicaba una destilación tediosa para separar el analito de especies interferentes, seguida de un delicado análisis espectrofotométrico, lo que lo hacía un método poco práctico, por complicado y costoso.
¿Cómo ayuda el fluoruro a inhibir la formación de caries?
Esmalte dental, una sonrisa saludable
En la Tierra, el material más duro que se puede extraer de una mina, un material natural, es el 💎 diamante. En el cuerpo humano, el material más duro que podemos encontrar es el esmalte dental cuyo componente principal es la hidroxiapatita.
La estructura y composición química del esmalte dental humano se estudia mediante técnicas de cristalografía, específicamente mediante imágenes de microscopía electrónica de alta resolución.
El esmalte que cubre los dientes contiene como mayor componente la hidroxiapatita, un hidroxifosfato de calcio. Este mineral, poco soluble en agua, se disuelve en ácido, porque tanto el PO43– como el OH– reaccionan con el H+.
La hidroxiapatita reacciona con materiales ácidos. Las bacterias, al adherirse a los dientes, fomentan la caries, debido al ácido láctico que producen al metabolizar azúcares. El ácido láctico reacciona con la hidroxiapatita, se disuelve, y empiezan a aparecer caries.
Fuente: https://journals.sagepub.com/doi/10.1177/00220345740530020401.
El fluoruro inhibe la formación de caries porque forma fluoroapatita, que es más resistente a los materiales ácidos que la hidroxiapatita. Los iones fluoruro, que tienen carácter químico de base débil, sustituyen en la red cristalina a los iones hidróxido, con carácter de base fuerte, convirtiendo al esmalte de los dientes en un material, que al ser menos básico, no reacciona tan fácilmente con los ácidos que las bacterias producen en nuestra boca a partir de los azúcares.
La necesidad analítica se resuelve
A mediados de la década de 1960, Martin S. Frant conoció en un anuncio la existencia de monocristales de fluoruros de tierras raras, utilizados para producir láseres; se le ocurrió que estos cristales podían responder de forma específica a los iones fluoruro que había estado investigando.
El primer cristal de NdF3, sellado dentro de un tubo de plástico con cera, dio una respuesta analíticamente aceptable y después de todo el trabajo científico y tecnológico que implica la investigación y desarrollo de un proceso, fue puesto al escrutrinio de la comunidad académica especializada.
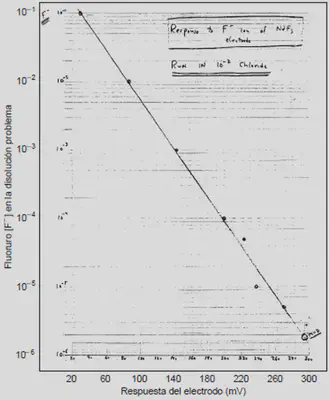
Fuente: https://pubs.acs.org/doi/abs/10.1021/ed074p159.
El mismo Martin S. Frant comentó en 1997:
…(el electrodo) tuvo casi aprobación inmediata de un gigante entre los químicos analíticos: Jim Lingane, investigador de Harvard, y su artículo (de 1967) convenció a muchos escépticos de que los electrodos selectivos de iones eran prácticos.
Los electrodos selectivos de iones no se basan en reacciones rédox. A diferencia de los electrodos metálicos, los electrodos selectivos de iones generan un potencial eléctrico por migración selectiva de un ion determinado a través de una membrana que idealmente es capaz de unirse sólo al ion que se pretende determinar.
Actualmente, los electrodos selectivos de fluoruro emplean un cristal de LaF3 dopado con Eu3+. Dopar significa añadir una pequeña cantidad de Eu3+ en lugar de La3+.
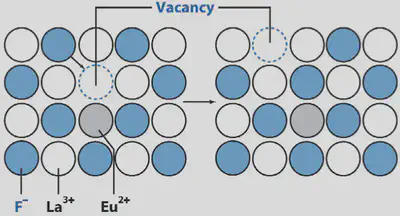
La disolución interior del electrodo selectivo de fluoruro es NaF 0.1 M y NaCl 0.1 M. Se usa, como se comentó al inicio, para controlar de forma continua la fluoración de abastecimiento de aguas municipales.
Referencias
- Scott, David B., James W. Simmelink, and Vibeke Nygaard. “Structural Aspects of Dental Caries.” Journal of Dental Research 53, 2 (1974): 165–78. https://doi.org/10.1177/00220345740530020401.
- Frant, Martin S. “Where Did Ion Selective Electrodes Come From?” J. Chem. Ed. 74, 2 (1997): 159. https://doi.org/10.1021/ed074p159.
Participa activamente en la web comentando, dando tu opinión, realizando peticiones, sugerencias...

Discord