Modelos atómicos
- Descubrimiento del electrón
- Modelo de Thomson
- Descubrimiento del núcleo atómico
- Modelo de Rutherford
- Modelo de Bohr
Descarga estas diapositivas en formato PDF 📥
Descubrimiento del electrón
En 1897, J.J. Thomson lleva a cabo su famoso experimento del tubo de rayos catódicos, con el que descubre el electrón, la partícula elemental con carga eléctrica negativa.
(continúa hacia abajo)
👇
Experimento del tubo de rayos catódicos

Resultados del experimento
- Los rayos catódicos se originaban en el cátodo y viajaban hacia el ánodo.
- Los rayos no eran visibles pero podían detectarse con una pantalla fluorescente.
- En ausencia de campos electromagnéticos externos, los rayos viajaban en línea recta.
- Al aplicar campos eléctricos y magnéticos, los rayos catódicos mostraban un comportamiento similar al de partículas con carga negativa.
- Las características de los rayos catódicos eran independientes de la naturaleza del gas contenido dentro del tubo y del material del que estaban formados los electrodos.
Modelo de Thomson
Siete años después de su famoso experimento, en 1904, Thomson postula un modelo atómico que se conoce como el modelo del pastel de pasas.
(continúa hacia abajo)
👇
- El átomo está formado por una nube esférica con carga positiva.
- Los electrones, con carga negativa, se encuentran incrustados por toda la esfera, como las pasas en un pastel.
- El número total de electrones es tal que la carga neta del átomo es cero (átomo neutro).

Descubrimiento del núcleo atómico
En 1911, Geiger y Marsden, dirigidos por Ernest Rutherford, llevan a cabo un experimento histórico en el que descubren la existencia del núcleo atómico.
(continúa hacia abajo)
👇
Experimento de Geiger-Marsden

Resultados del experimento
- La mayoría de las partículas atravesaban la lámina de oro sin desviarse.
- Muy pocas (1/10000 aproximadamente) se desviaban un ángulo mayor de unos 10°.
- Algunas partículas (poquísimas) incluso rebotaban.
Interpretación de Rutherford

- Si el modelo propuesto por Thomson fuera cierto, no deberían observarse desviaciones ni rebotes de las partículas incidentes.
- Las partículas se desvían al encontrar en su trayectoria una zona muy pequeña (núcleo) cargada positivamente, donde se concentra la mayor parte de la masa del átomo.
Puedes entender mejor las conclusiones del experimento de Rutherford con esta simulación:
Modelo de Rutherford
- El átomo está formado por un núcleo, muy pequeño comparado con el tamaño del átomo, con carga positiva y donde se concentra casi toda su masa.
- Los electrones, con carga negativa, giran alrededor del núcleo como lo hacen los planetas alrededor del Sol.
(continúa hacia abajo)
👇

Modelo de Bohr
Propuesto en 1913 por Niels Bohr para explicar la estabilidad de la materia y los característicos espectros de emisión y absorción de los gases.
(continúa hacia abajo)
👇

¿Cómo son los espectros de emisión del resto de elementos químicos de la tabla periódica?
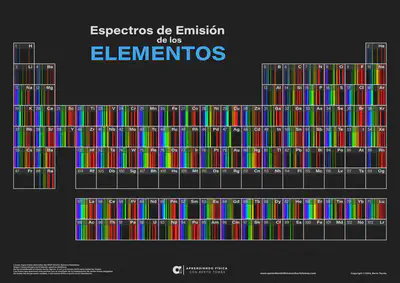
Si quieres aprender más sobre espectros atómicos te recomendamos leer esta interesante entrada del blog.
Postulados
Este modelo se basa en tres postulados fundamentales:
- Los electrones describen órbitas circulares en torno al núcleo sin irradiar energía.
- Solo algunas órbitas están permitidas.
- El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra, siendo la energía emitida/absorbida la diferencia de energía entre ambos niveles.

Exportar a PDF
📥 Pincha aquí y sigue estas instrucciones:
- Abre el diálogo de Impresión (Control-P si estás en Windows).
- Cambia el Destino a Guardar como PDF.
- Cambia el Diseño a Horizontal.
- Cambia los Márgenes a Ninguno.
- Activa la opción Gráficos de fondo.
El proceso, en principio, solo funciona con Google Chrome.